- 2025新澳天天彩免费粒303
- 943333王中王开奖结果十百度十百度五
- 新奥今晚平特一肖结果
- 2025新澳天天彩免費
- 2025年正版天天免费开
- 777788888888精准
- 77777788888王中王中特亮点
- 7777788888王中王凤凰网中特开奖结果
- 澳门一码一特中奖号码预测
- 2025澳门正版免费资本车真相
- 天天彩澳门天天彩今晚
- 7777888888免费四肖
- 77777788888王中王中特点亮
- 2025天天开好彩免费大全
- 777788888888王中王
- 2025新澳门天天开好彩大乐透开奖结果8
- 打开港澳宝典开奖记录
- 六和彩资料网站下载
- 香港码开奖结果查询结果
- 新门最精准最精准免费
- 2025年天天免费资料
- 2025天天免费正版资料
- 7777788888管家婆凤凰网
- 2025新澳门黄大仙
- 新门内部资料大全免费
- 新门内部免费资料大全
- 港澳宝典玄机图
- 2025澳门9点35分开06
- 2025新澳历史记录查询结果
- 77777888888免费4肖真相
- 王中王开奖结果
- 7777788888准新传真
- 123澳门正版资料免费查询
- 港澳宝典1133开奖网
- 2025新澳天天彩免费粒
- 宝典图库大全资料
- 今晚香港9点35分开06
- 管家婆三期必开一期精准预测
- 2025新澳天天彩藏宝图
- 7777788888新王中王彩
- 2025天天开好彩大全开奖结果是什么
- 2025新澳天天彩正板大全
- 香港资料免费长期公开
- 7777788888免费精准生肖
- 彩库宝典图库大全
- 555525王中王心水高手
- 新澳和老澳两种彩票是一样吗
- 澳门精准资料大全
- 新澳门天天彩免费精准大全谜语
- 2025新澳历史记录查询
- 2025年澳门正版免费资本车
- 2025新澳门天天精准大全谜语
- 2025新澳天天正版免费观看
- 一肖一码100能中多少钱
- 2025新澳门天天免费准大全谜语
- 新澳门天天精准大全谜语
- 2025新澳天天精准大全谜语
- 2025年新澳开奖结果
- 新澳门天天免费谜语下一期
- 正版挂牌之全篇100
- 2025新奥天天开好彩收益说明解析
- 7777788888精准传真解析
- 新澳门天天免费谜语题库
- 2025新澳天天彩303开奖结果
- 77777888888免费四肖
- 2025年天天免费资料香港
- 澳门管家婆100精准香港谜语今天的谜
- 7777888888新奥精准
- 7777788888王中王中王来源
- 澳门一肖一码一恃一中下一期预测
- 2025管家婆精选资料
- 新澳今晚开一肖一特预测和
- 2025年天天彩免费大全
- 2025新澳历史结果
- 727236王中王开奖结果
- 600图库资料2025年
- 澳门一肖一马一恃一中下一期预测
- 2025年澳门正版免费本
- 2025新门正版免费资本
- 7777788888马会传真
- 新澳门六天天开好彩下一期预测
- 2025新奥天天彩大全正版免费
- 2025年天天免费资料
- 港澳免费精准资料大全
- 727236王中王开奖结果历史查询表
- 7777788888香港马
- 2025天天好免费资料
- 49图库下载 49图库港澳
- 2025年天天免费资料香港
- 全网最准资料一朱雀网
- 天天彩澳门天天彩正版
- 新门内部资料免费公开
- 香港直播开奖结果+开奖记录
- 2025年天天彩免费大全49
- 555525王中王心水高手灵蛇
- 2025天天正版资料免费大全
- 2025年新澳门历史记录查询
- 7777788888王中新版
- 2025年天天开彩资料查询结果
- 77788888888王中王
港彩高手出版精料
澳门精华区
香港精华区
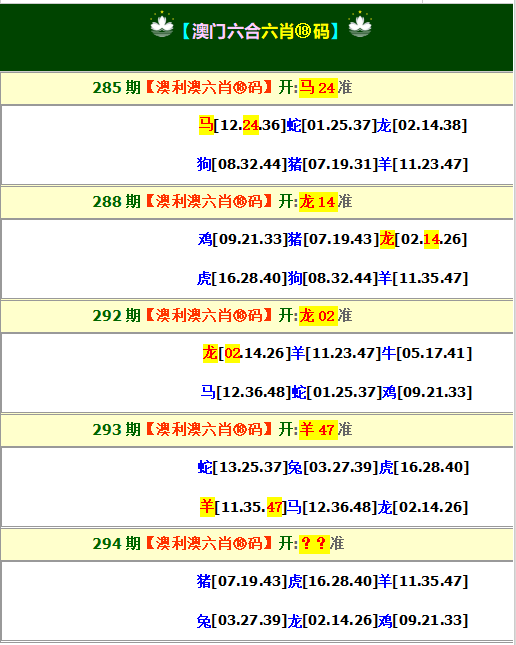
- 293期:【贴身侍从】必中双波 已公开
- 293期:【过路友人】一码中特 已公开
- 293期:【熬出头儿】绝杀两肖 已公开
- 293期:【匆匆一见】稳杀5码 已公开
- 293期:【风尘满身】绝杀①尾 已公开
- 293期:【秋冬冗长】禁二合数 已公开
- 293期:【三分酒意】绝杀一头 已公开
- 293期:【最爱自己】必出24码 已公开
- 293期:【猫三狗四】绝杀一段 已公开
- 293期:【白衫学长】绝杀一肖 已公开
- 293期:【满目河山】双波中 已公开
- 293期:【寥若星辰】特码3行 已公开
- 293期:【凡间来客】七尾中特 已公开
- 293期:【川岛出逃】双波中特 已公开
- 293期:【初心依旧】绝杀四肖 已公开
- 293期:【真知灼见】7肖中特 已公开
- 293期:【四虎归山】特码单双 已公开
- 293期:【夜晚归客】八肖选 已公开
- 293期:【夏日奇遇】稳杀二尾 已公开
- 293期:【感慨人生】平特一肖 已公开
- 293期:【回忆往事】男女中特 已公开
- 293期:【疯狂一夜】单双中特 已公开
- 293期:【道士出山】绝杀二肖 已公开
- 293期:【相逢一笑】六肖中特 已公开
- 293期:【两只老虎】绝杀半波 已公开
- 293期:【无地自容】绝杀三肖 已公开
- 293期:【凉亭相遇】六肖中 已公开
- 293期:【我本闲凉】稳杀12码 已公开
- 293期:【兴趣部落】必中波色 已公开
管家婆一句话

天天好彩【六肖中特】
天天好彩【平尾心水秘籍】
天天好彩【幽默猜测】
天天好彩澳门正版图库
- 澳门四不像
- 澳门传真图
- 澳门跑马图
- 新挂牌彩图
- 另版跑狗图
- 老版跑狗图
- 澳门玄机图
- 玄机妙语图
- 六麒麟透码
- 平特一肖图
- 一字解特码
- 新特码诗句
- 四不像玄机
- 小黄人幽默
- 新生活幽默
- 30码中特图
- 澳门抓码王
- 澳门天线宝
- 澳门一样发
- 曾道人暗语
- 鱼跃龙门报
- 无敌猪哥报
- 特码快递报
- 一句真言图
- 新图库禁肖
- 三怪禁肖图
- 正版通天报
- 三八婆密报
- 博彩平特报
- 七肖中特报
- 神童透码报
- 内幕特肖B
- 内幕特肖A
- 内部传真报
- 澳门牛头报
- 千手观音图
- 梦儿数码报
- 六合家宝B
- 合家中宝A
- 六合简报图
- 六合英雄报
- 澳话中有意
- 彩霸王六肖
- 马会火烧图
- 狼女侠客图
- 凤姐30码图
- 劲爆龙虎榜
- 管家婆密传
- 澳门大陆仔
- 传真八点料
- 波肖尾门报
- 红姐内幕图
- 白小姐会员
- 白小姐密报
- 澳门大陆报
- 波肖一波中
- 庄家吃码图
- 发财波局报
- 36码中特图
- 澳门男人味
- 澳门蛇蛋图
- 白小姐救世
- 周公玄机报
- 值日生肖图
- 凤凰卜封图
- 腾算策略报
- 看图抓码图
- 神奇八卦图
- 新趣味幽默
- 澳门老人报
- 澳门女财神
- 澳门青龙报
- 财神玄机报
- 内幕传真图
- 每日闲情图
- 澳门女人味
- 澳门签牌图
- 澳六合头条
- 澳门码头诗
- 澳门两肖特
- 澳门猛虎报
- 金钱豹功夫
- 看图解特码
- 今日闲情1
- 开心果先锋
- 今日闲情2
- 济公有真言
- 四组三连肖
- 金多宝传真
- 皇道吉日图
- 澳幽默猜测
- 澳门红虎图
- 澳门七星图
- 功夫早茶图
- 鬼谷子爆肖
- 观音彩码报
- 澳门不夜城
- 挂牌平特报
- 新管家婆图
- 凤凰天机图
- 赌王心水图
- 佛祖禁肖图
- 财神报料图
- 二尾四码图
- 东成西就图
- 12码中特图
- 单双中特图
- 八仙指路图
- 八仙过海图
- 正版射牌图
- 澳门孩童报
- 通天报解码
- 澳门熊出没
- 铁板神算图
澳门天天好彩人气超高好料
澳门天天好彩免费资料大全
- 杀料专区
- 独家资料
- 独家九肖
- 高手九肖
- 澳门六肖
- 澳门三肖
- 云楚官人
- 富奇秦准
- 竹影梅花
- 西门庆料
- 皇帝猛料
- 旺角传真
- 福星金牌
- 官方独家
- 贵宾准料
- 旺角好料
- 发财精料
- 创富好料
- 水果高手
- 澳门中彩
- 澳门来料
- 王中王料
- 六合财神
- 六合皇料
- 葡京赌侠
- 大刀皇料
- 四柱预测
- 东方心经
- 特码玄机
- 小龙人料
- 水果奶奶
- 澳门高手
- 心水资料
- 宝宝高手
- 18点来料
- 澳门好彩
- 刘伯温料
- 官方供料
- 天下精英
- 金明世家
- 澳门官方
- 彩券公司
- 凤凰马经
- 各坛精料
- 特区天顺
- 博发世家
- 高手杀料
- 蓝月亮料
- 十虎权威
- 彩坛至尊
- 传真內幕
- 任我发料
- 澳门赌圣
- 镇坛之宝
- 精料赌圣
- 彩票心水
- 曾氏集团
- 白姐信息
- 曾女士料
- 满堂红网
- 彩票赢家
- 澳门原创
- 黃大仙料
- 原创猛料
- 各坛高手
- 高手猛料
- 外站精料
- 平肖平码
- 澳门彩票
- 马会绝杀
- 金多宝网
- 鬼谷子网
- 管家婆网
- 曾道原创
- 白姐最准
- 赛马会料